
news
新闻中心
FISH检测(专题十)—CSCO淋巴瘤诊疗指南(2021年版)(二)
为了进一步提高对肿瘤的认识以及对肿瘤的规范诊疗和研究,中国临床肿瘤学会(CSCO)相关肿瘤专家委员会根据最新肿瘤研究进展及临床需要对乳腺癌等23种肿瘤的诊疗指南进行了修订,出版了新的肿瘤诊疗指南(2021年版)。为此,康录生物将对各个诊疗指南中涉及FISH检测的相关内容进行解析。
今天,我们将对淋巴瘤诊疗指南(2021年版)中涉及FISH检测与弥漫性大B细胞淋巴瘤、高级别B细胞淋巴瘤的相关内容进行解析。

弥漫性大B细胞淋巴瘤(DLBCL)是肿瘤性大B淋巴细胞呈弥漫性生长,肿瘤细胞的核与正常组织细胞的核大小相近或大于组织细胞的核,通常大于正常淋巴细胞的2倍。
DLBCL是成人淋巴瘤中最常见的的一种亚型,并且是一组在临床表现、组织形态和预后等多方面具有很大异质性的恶性肿瘤。其发病率占非霍奇金淋巴瘤(NHL)的31%~34%,在亚洲国家一般大于40%[1-2]。我国2011年一项由24个中心联合进行、共收集10002例病例样本的分析报告指出,在中国DLBCL占所有NHL的45.8%,占所有淋巴瘤的40.1%[3]。DLBCL主要发生在中老年人,儿童罕见,中位发病年龄为60-70岁。男性较女性多发。近年来,DLBCL的发病率持续上升,DLBCL的诊断及治疗也出现了一些变化。
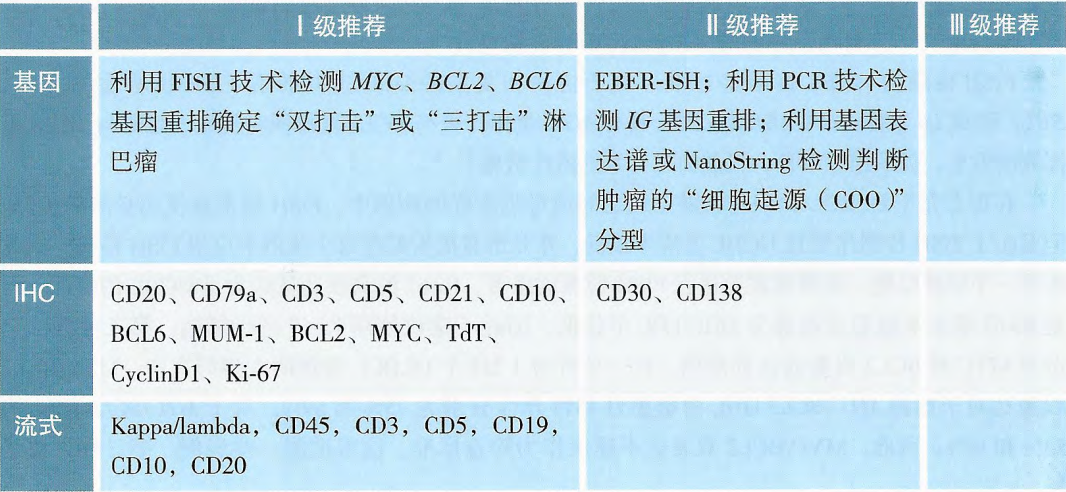
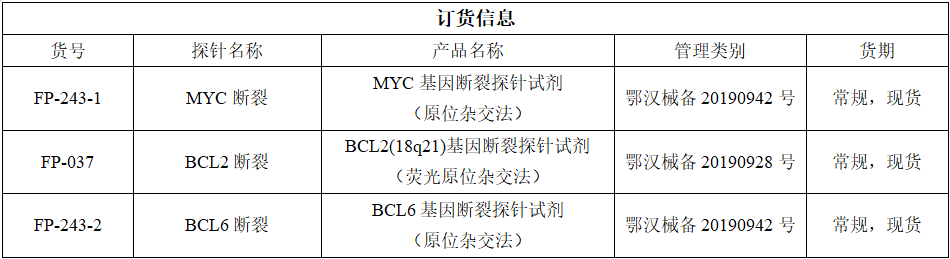
为了提高DLBCL分型的预后判断价值,选择更合适的治疗,研究者们在免疫组织化学分型基础上加入细胞遗传学改变。采用常规染色体检测及荧光原位杂交(FISH)技术检测,发现在DLBCL中,一些患者有MYC和BCL2基因重排或BCL6基因重排,被称为双打击大B细胞淋巴瘤(DHL)。还有少部分患者同时伴MYC、BCL2和BCL6基因重排,被称为三打击淋巴瘤(THL)。DHL及THL患者约占DLBCL的5%,且常为GCB亚型,这些亚型好发于老年人,预后相对较差,对常规治疗方案不敏感[4-6]。2016年更新的世界卫生组织(WHO)淋巴瘤分类标准已将DHL及THL纳入了一新的类别高级别B细胞淋巴瘤[7]。
因此,对于DLBCL的诊断来说,尽管其主要依靠活检组织病理学和免疫组化分析明确诊断,但在2021年CSCO淋巴瘤诊疗指南中明确提出:对于初发和治疗后复发的DLBCL患者均推荐FISH技术检测MYC、BCL2和BCL6重排,以鉴别高级别B细胞淋巴瘤(I级推荐)。
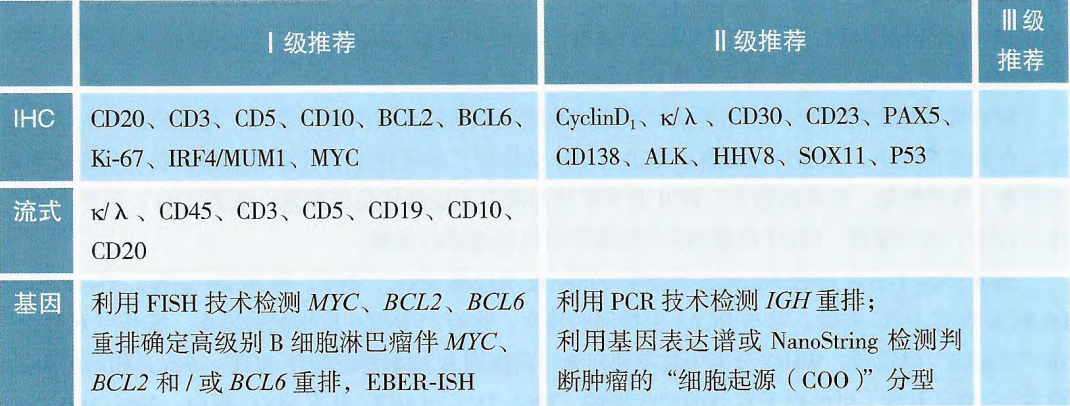
高级别B细胞淋巴瘤(HGBL)传统上被用作侵袭性B细胞淋巴瘤的统称,这种B细胞淋巴瘤在形态学上表现出高级别特征,包括多个有丝分裂象、星空图案、较高的Ki-67等。但在2016年世界卫生组织(WHO)淋巴瘤分类重新定义了HGBL。
2016年WHO第四版恶性淋巴瘤补充分类中取消了2008年WHO分类中“形态学介于弥漫大B细胞淋巴瘤(DLBCL)和Burkitt淋巴瘤之间不能分类的B细胞淋巴瘤”的暂定分类,取而代之的定义了HGBL。HGBL指是一种形态学和遗传学特点介于弥漫大B细胞淋巴瘤(DLBCL)和伯基特淋巴瘤(BL)之间的一类高侵袭性的淋巴瘤,占所有NHL的1%~2%[7]。根据2016年第四版WHO最新分类,将HGBL可分为两类:①HGBL,伴有MYC和BCL2和/或BCL6重排,即双重打击淋巴瘤(DHL)或三重打击淋巴瘤(THL);②HGBL,非特指(HGBL,NOS):形态为母细胞样或介于DLBCL与伯基特淋巴瘤之间,但缺乏MYC和BCL2和/或BCL6共同重排(可以有MYC或BCL2单个基因重排)的病例,强调需排除“双打击”/“三打击”淋巴瘤以及确诊DLBCL的患者。
不同类型的HGBL存在不同的特征。对于DHL来说,回顾性研究表明65%~70%的DHL患者同时存在MYC、BCL2易位,14%~20%的患者仅涉及MYC、BCL6,其他患者同时存在MYC、BCL2和BCL6癌基因重排[8,9]。DHL患者的中位年龄约为60岁(17~87岁),且多为男性,大多数患者为临床晚期(III/IV期),25~30%的患者表现不佳(ECOG≥2),大多数(90%)患者的国际预后指数(IPI)评分为中到高。研究发现,MYC/BCL2DHL患者B细胞标志物均为阳性,但往往伴有CD19和CD20低表达及CD10、CD38高表达[10]。与MYC/BCL2DHL相比,MYC/BCL6DHL中CD10、BCL2、TP53突变的表达相对较少,但Mmu-1/IRF4普遍表达[11,12]。在分子水平上几乎所有MYC/BCL2DHL均为生发中心细胞(GCB)表型,而MYC/BCL6DHL则以非GCB表型为主[13]。MYC/BCL6DHL可能是所有亚型中预后最差的,因为该类型中非GCB来源的比例明显增高。此外MYC/BCL2DHL和THL患者相比,MYC/BCL6DHL患者更常发生结外疾病(58%、48%比88%)[14]。
需要强调的是DHL不等同于双表达淋巴瘤(DEL),DEL是通过免疫组化检测来定义的,同时具有MYC和BCL2蛋白高表达的DLBCL被称为DEL。其界值在不同的研究中不完全一致,大部分研究将MYC≥40%,BCL2≥50%定义为高表达。DEL与DHL是两个不同的疾病实体,没有MYC和BCL2/BCL6基因重排[15]。多数研究认为DEL预后差,RCHOP治疗后结局不良,且为独立的预后因素[16],但其预后通常比DHL要好,DEL的诊断依然是DLBCL[17]。
与DHL相比,THL相对罕见,文献中关于这一亚型的报道相对较少。但已报道的数据显示其临床特征、形态学、免疫表型等与MYC/BCL2DHL相似。还有相关研究表明[18],大多数THL病例CD10、BCL2、BCL6、MYC、FOXP1表达阳性,对常规化疗反应差,90%以上的患者治疗后进展为复发难治性疾病,OS率很低。但也有研究表明尽管同时存在BCL6重排,但THL患者的预后仍与MYC/BCL2DHL患者相似[19]。
HGBL-NOS基本上相当于以前的BCLU,但不包括DHL和THL。HGBL的这一亚群使用病理标准分为三个亚型[20]:第一种亚型肿瘤具有弥漫性且呈星空图案,细胞大小不一,核特征介于DLBCL和BL之间;第二种亚型在形态和免疫表型上都类似于BL,但免疫组织化学检测BCL2表达呈阳性,并且核型通常很复杂;第三种亚型类似于淋巴母细胞淋巴瘤,但往往具有成熟的B细胞免疫表型,如CD19、CD20等。HGBL-NOS多数表现为GCB亚型,但也有少部分为ABC型,在无MYC重排的情况下BCL2、BCL6可以孤立或同时重排,也可同时存在MYC、BCL2或BCL6的过度表达[21]。既往较少研究报道这种罕见淋巴瘤,其诊断和鉴别诊断仍具有挑战性。
传统的细胞遗传学分析在DHL/THL诊断中很重要,但近50%的病例缺乏典型的核型。随着FISH检测技术的普及,使得DHL/THL的检出率明显提高。因此,包括2021版中国CSCO指南在内的很多相关指南提出:FISH检测是HGBL诊断金标准。在形态学介于DLBCL和伯基特淋巴瘤之间或母细胞样的病例中,FISH通常为视为必需的检测。利用FISH技术检测MYC、BCL2、BCL6基因重排以确定“双打击”或“三打击”淋巴瘤。
由于HGBL相对罕见,缺乏足够的前瞻性数据,因此制定其最佳治疗方案具有挑战性。回顾性研究表明,高强度的免疫化疗方案可能改善双打击/三打击淋巴瘤患者的预后,而采用RCHOP方案可能预后较差[22,23]。在对106例双打击/三打击淋巴瘤的多中心回顾性分析中,采用高强度免疫化疗方案(如R-DA-EPOCH,R-HyperCVAD或R-CODOX-M/IVAC)相比RCHOP可改善CR率及PFS[24]。另一项荟萃分析表明,在双打击淋巴瘤患者的一线治疗中,采用RCHOP,R-DA-EPOCH及其他剂量密集型方案的中位PFS分别为12个月、22个月和19个月;同时研究发现,相比RCHOP方案,R-DA-EPOCH显著降低了无进展风险,但各组间的OS未见显著差异[25]。而针对HGBL-NOS,国际上目前尚无统一的标准治疗方案,不同于双打击/三打击淋巴瘤的是,研究发现RCHOP方案可作为其治疗选择的方案之一。基于此,针对HGBL的双打击、三打击以及非特指型,CSCO淋巴瘤诊疗指南也给出了不同的治疗方案,如下图所示:


MYC:
MYC基因(特指C-MYC)是位于8q24上的原癌基因,可通过编码转录因子控制细胞周期、增殖、代谢及生物合成等[26]。研究表明MYC基因易位将导致MYC蛋白高表达,细胞出现失控性生长[27]。在正常情况下MYC基因沉默,当发生基因扩增或易位时被激活,进而调控细胞周期,在淋巴瘤的发生、发展中发挥重要作用。
BCL2:
BCL2即B细胞淋巴瘤/白血病-2基因,位于18号染色体,是一种具备稳定线粒体膜通透性作用的肿瘤凋亡抑制基因,通过抑制Caspase-3、6、9的活性进而抑制细胞凋亡。另外,BCL2还能通过多位点磷酸化调控细胞由G0期向S期转化,影响细胞增生。大量研究表明,BCL2的失调机制与MYC相似,通过染色体易位、基因扩增、NF-κB信号增加等导致BCL2蛋白表达增加,产生很强的抗凋亡活性,从而促进癌细胞的增殖[28]。
BCL6:
BCL6编码基因位于3q27,其转录翻译后形成的蛋白对于GCB形成和维持生发中心B细胞的存活起重要作用[29],变异后的BCL6对BCL2和MYC突变的抑制作用失效最终导致肿瘤细胞存活及异常增殖[30]。
部分参考文献:
1.Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of the Haematopoietic and Lymphoid Tissues. Revised 4th ed Lyon, France: IARC; 2017.
2.Li S,Saksena A,Desai P, et al. Prognostic impact of history of follicular lymphoma,induction regimen and stem cell transplant in patients with MYC/BCL2 double hit lymphoma. Oncotarget, 2016, 7(25):38122-38132.
3.Landsburg DJ, Petrich AM,Abramson JS, et al. Impact of oncogene rearrangement patterns on outcomes in patients with double-hit non-Hodgkin lymphoma. Cancer, 2016, 122(4):559-564.
4.Li S, Lin P, Medeiros LJ. Advances in pathological understanding of high-grade B cell lymphomas. Expert Rev Hematol. 2018;11(8):637-648.
5.Ott G. Aggressive B-cell lymphomas in the update of the 4th edition of the World Health Organization classification of haematopoietic and lymphatic tissu:refinements of the classification,new entities and genetic findings. Br J Haematol, 2017, 178(6):871-887.
6.SAVAGE KJ, JOHNSON NA, BEN-NERIAH S, et al. MYC gene rearrangements are associated with a poor prognosis in diffuse large B-cell lymphoma patients treated with R-CHOP chemotherapy. Blood, 2009, 114 (17): 3533-3537.
7.LIN P, DICKASON TJ, FAYAD LE, et al. Prognostic value of MYC rearrangement in cases of B-cell lymphoma, unclassifiable, with features intermediate between diffuse large B-cell lymphoma and Burkitt lymphoma. Cancer, 2012, 118 (6): 1566-1573.
8.OK CY, MEDEIROS LJ. High-grade B-cell lymphoma: a term re-purposed in the revised WHO classification. Pathology, 2020, 52 (1): 68-77.